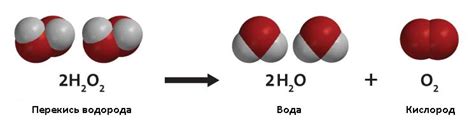
Перекись водорода (перекись водорода, водородная перекись, H2O2) – это химическое соединение, известное своими окислительными свойствами. Вещество образуется в результате реакции между молекулами воды и активным кислородом, причем вторая молекула воды разлагается при этом на два атома водорода и один атом кислорода.
Перекись водорода широко используется в различных отраслях науки и промышленности. В медицине она применяется как мощный антиоксидант и антимикробное средство. В косметологии перекись водорода используется для отбеливания зубов и смягчения кожи. Кроме того, она является важным компонентом в процессе балансировки оксидоредукционных реакций.
Балансировка оксидоредукционных реакций – это процесс выравнивания количества окислительных и восстановительных частиц, участвующих в реакции. Перекись водорода выступает в таких реакциях в роли окислителя, т.е. она передает кислородные атомы другим веществам. В результате окислительного взаимодействия перекиси водорода с веществами происходит изменение степеней окисления атомов веществ и образуются новые соединения.
Принцип действия перекиси водорода
Принцип действия перекиси водорода основан на ее способности выступать как окислитель и восстановитель. Эта способность связана с нестабильностью молекулы перекиси водорода, которая может легко разлагаться на воду и молекулярный кислород.
В окислительных реакциях перекись водорода выступает в качестве донора кислорода, перенося его к другим веществам. Окисление происходит путем передачи электронов от перекиси водорода к принимающему веществу. Так, перекись водорода может окислять органические и неорганические соединения, разрушая их структуру.
Восстановительные свойства перекиси водорода проявляются в реакциях, когда она принимает электроны от других веществ. В результате перекись водорода сама разлагается на воду и кислород, освобождая энергию. Это свойство используется, например, в батареях источников питания, где перекись водорода служит восстанавливающим агентом.
Принцип действия перекиси водорода в химических реакциях может быть описан с помощью химических уравнений. Например, реакция между перекисью водорода и йодидом калия выглядит следующим образом:
H2O2 + 2KI → 2H2O + O2 + 2KOH
Эта реакция показывает, что перекись водорода окисляет йодид и в результате образуются вода, молекулярный кислород и гидроксид калия.
Таким образом, принцип действия перекиси водорода основан на ее окислительных и восстановительных свойствах, которые позволяют ей участвовать в различных химических реакциях и применяться в разных областях науки и техники.
Химические реакции и перекись водорода

Одним из принципов действия перекиси водорода в химических реакциях является ее способность окислять другие вещества. В процессе окисления перекиси водорода образуются кислородные радикалы (О•) и вода (H2O). Кислородные радикалы обладают высокой реакционной активностью и способны проникать в химические связи других молекул, вызывая окислительные реакции.
Перекись водорода широко используется в различных отраслях промышленности. Она применяется в процессе отбеливания и стерилизации, в производстве бумаги и целлюлозы, в производстве кожи и текстиля, а также в медицине. В промышленности ее часто используют в качестве окислителя и отбеливателя, так как она не оставляет остатков и обладает высокой активностью.
Балансировка окислительно-восстановительных реакций, в которых принимает участие перекись водорода, является важной задачей. Балансировка позволяет правильно установить соотношение между реагентами и продуктами реакции с учетом закона сохранения массы. В процессе балансировки необходимо удовлетворить условия сохранения массы и заряда.
Существует несколько способов балансировки окислительно-восстановительных реакций с участием перекиси водорода, включая метод полууравнивания и метод изменения коэффициентов. В обоих случаях необходимо учитывать окислительно-восстановительные числа элементов и их изменения в процессе реакции.
- Метод полууравнивания основан на разделении реакции на полуреакции окисления и восстановления. Затем каждую полуреакцию необходимо балансировать в отдельности, учитывая изменения окислительно-восстановительных чисел.
- Метод изменения коэффициентов основан на балансировке всей реакции сразу. При этом необходимо изменять коэффициенты перед формулами реагентов и продуктов так, чтобы соблюдалась массовая и электрическая балансировка.
Балансировка окислительно-восстановительных реакций с участием перекиси водорода требует внимательности и знания основ химических реакций. Она является важным этапом понимания и изучения принципов действия перекиси водорода в химии.
Роль перекиси водорода в балансировке ОВП
Перекись водорода может вести себя как окислитель, передавая кислородные атомы или как восстановитель, получая кислородные атомы. В реакциях, где перекись водорода выступает в роли окислителя, она окисляет другие вещества, передавая им кислородные атомы. Таким образом, она сама восстанавливается, образуя воду (H2O).
С другой стороны, в реакциях, где перекись водорода выступает в роли восстановителя, она получает кислородные атомы от других веществ и сама превращается в воду. В процессе балансировки ОВП в химических реакциях, перекись водорода может быть использована для снижения степени окисления одного ионного электрода или восстановления другого.
Благодаря своим свойствам окислителя и восстановителя, перекись водорода позволяет балансировать окислительно-восстановительные реакции, обеспечивая перенос электронов между различными веществами и поддерживая электронный баланс в системе. Это позволяет достичь стабильности в химических процессах и обеспечить их эффективное протекание.
Таким образом, перекись водорода играет важную роль в балансировке окислительно-восстановительных процессов, обеспечивая перенос электронов и поддерживая электронный баланс. Это делает ее неотъемлемым реагентом во многих химических реакциях, где требуется балансировка ОВП и обеспечение эффективного протекания процессов.
Балансировка ОВП в химических реакциях
При балансировке ОВП необходимо учитывать заряды и количество атомов каждого элемента в реагентах и продуктах. Для этого можно использовать различные методы, такие как метод полуколичественных электронных уравнений или метод окислительно-восстановительных мнемонических шаблонов.
Процесс балансировки ОВП может быть сложным и требует внимательности. Неконтролируемый ОВП может привести к потере энергии и неэффективному использованию реагентов. Правильная балансировка ОВП также позволяет оценить эффективность реакции и определить, какие факторы могут влиять на ее результат.
Методы балансировки ОВП
Балансировка оксидационно-восстановительных потенциалов (ОВП) играет важную роль в химических реакциях, где участвует перекись водорода. Существует несколько методов балансировки ОВП, которые позволяют достичь оптимальной эффективности и контроля над реакцией.
1. Метод активационного обмена ионами
Данный метод основан на изменении концентрации ионов в растворе. Путем добавления соответствующих реагентов, можно увеличить или уменьшить концентрацию ионов, что приведет к изменению ОВП.
2. Метод использования катализаторов
Катализаторы являются важным инструментом при балансировке ОВП, так как они ускоряют химическую реакцию. Путем выбора подходящего катализатора, можно достичь балансировки ОВП и увеличить скорость реакции с перекисью водорода.
3. Метод изменения температуры
Температура также оказывает влияние на ОВП. Путем изменения температуры, можно достичь балансировки ОВП и контролировать химическую реакцию с перекисью водорода.
4. Метод изменения pH
Изменение значения pH может также повлиять на ОВП. Увеличение или уменьшение pH может привести к более эффективной балансировке ОВП при реакции с перекисью водорода.
Правильная балансировка ОВП является ключевым фактором в химических реакциях с перекисью водорода. Сочетание различных методов может обеспечить оптимальные условия для проведения реакции и достижения желаемых результатов.
Важность балансировки ОВП

ОВП отражает возможность вещества окислиться или восстановиться и обычно выражается в вольтах. Взаимодействие перекиси водорода с другими веществами основывается на овсем снижении или повышении ОВП.
Балансировка ОВП подразумевает сохранение равновесия между окислительными и восстановительными процессами в реакции. Это важно, поскольку небалансированный ОВП может привести к нежелательным побочным реакциям или нарушению структуры и функций биологических систем.
Контроль ОВП особенно важен в биологических системах, так как многие биохимические процессы зависят от правильного функционирования окислительно-восстановительных реакций. Например, в клетках человека баланс ОВП играет решающую роль в поддержании здоровья и предотвращении развития различных заболеваний, таких как рак, диабет и сердечно-сосудистые заболевания.
Балансировка ОВП также имеет важное значение при проведении химических реакций в промышленных процессах. Неконтролируемый ОВП может привести к неправильному образованию продуктов, ухудшению качества и эффективности процесса.