Химия является фундаментальной наукой, которая изучает строение, свойства и превращения веществ. Одним из важных понятий в химии является степень окисления, которая играет ключевую роль в химических реакциях и позволяет определить изменение заряда атома в химическом соединении.
Определение степени окисления основано на правилах, которые помогают определить количество электронов, переданных атомом другому атому в процессе окисления или восстановления. Для этого необходимо знать электроотрицательность атомов в соединении и их структуру.
Например, водород (H) имеет электроотрицательность 2, а кислород (O) - 3. Если вода (H2O) окисляется до перекиси водорода (H2O2), то степень окисления водорода увеличивается с 1 до 2, а степень окисления кислорода изменяется с 0 до -1. Таким образом, вода содержит ион водорода с положительной степенью окисления и ион кислорода с отрицательной степенью окисления.
Что такое степень окисления в химии?

Степень окисления атома позволяет определить, сколько электронов он получил или потерял при образовании химического соединения. Степень окисления обычно указывается с помощью чисел и знаков, где положительные числа указывают на окисление, а отрицательные - на восстановление.
Степень окисления атома может быть определена по нескольким правилам, включая правило о том, что атом чистого элемента имеет степень окисления равную нулю, и что степень окисления монатомных ионов равна их заряду. Также существует ряд правил для определения степени окисления атомов в различных классах соединений, таких как оксиды, гидриды, соли и органические соединения.
Знание степеней окисления важно для понимания реакций окисления-восстановления и реакций химического обмена. Определение степени окисления атомов в химических соединениях помогает установить тип соединения, его свойства и реактивность.
| Примеры степени окисления | Степень окисления |
|---|---|
| Кислород в воде (H2O) | -2 |
| Водород в воде (H2O) | +1 |
| Азот в аммонии (NH4+) | -3 |
| Азот в азотной кислоте (HNO3) | +5 |
Как определяется степень окисления?

Существует несколько способов определить степень окисления:
1. По электроотрицательности элемента. Электроотрицательность элемента является его способностью притягивать электроны. Если элемент притягивает электроны сильнее, то его степень окисления будет отрицательной, а если слабее, то положительной. Например, водород (H) имеет максимальную электроотрицательность 2.1, а хлор (Cl) - 3.0. В молекуле HCl, водород имеет степень окисления +1, а хлор -1.
2. По заряду ионов. В ионных соединениях, где атомы переходят в ионы, степень окисления можно определить по заряду иона. Например, в ионе Fe3+ степень окисления железа равна +3, а в ионе O2- -2.
3. По известной сумме степеней окисления. В некоторых случаях, когда сумма степеней окисления в молекуле или ионе известна, можно определить степень окисления отдельного атома путем вычитания из известной суммы степени окисления других атомов. Например, в молекуле H2O общая сумма степеней окисления равна 0 (2*(-2) + 1*2 = 0), поэтому степень окисления кислорода равна -2.
Определение степени окисления является важным шагом в химических расчетах и позволяет определить химические свойства вещества.
Механизмы определения степени окисления

Первый механизм – это правила определения степени окисления, которые основаны на распределении электронов в химическом соединении. Согласно этим правилам, атомы в совокупности с электронными зарядами и другими факторами могут иметь положительную, отрицательную или нулевую степень окисления.
Примером применения правил определения степени окисления является определение степени окисления в молекуле воды (H2O). Согласно правилам, водород (H) всегда имеет степень окисления +1, кислород (O) – степень окисления -2. Таким образом, в молекуле воды степень окисления водорода составляет +2 (+1 * 2), а кислорода – -4 (-2 * 2). Чтобы обеспечить электрическую нейтральность молекулы, степень окисления кислорода должна быть суммирована до -2. Следовательно, степень окисления одного атома кислорода в молекуле воды составляет -2.
Помимо правил определения степени окисления, существуют и другие методы, позволяющие определить степень окисления. Например, электрохимические методы, такие как вольтамперометрия, используют изменение потенциала в процессе окислительно-восстановительных реакций для определения степени окисления атомов.
Кроме того, спектроскопические методы, такие как ядерный магнитный резонанс (ЯМР) и рентгеновская фотоэлектронная спектроскопия (XPS), могут быть использованы для определения степени окисления. Эти методы основаны на измерении расщепления энергетических уровней атомов и исследовании их электронной структуры.
В итоге, определение степени окисления может быть выполнено различными методами в зависимости от химической системы и требуемой точности определения. Правила определения степени окисления, электрохимические и спектроскопические методы позволяют нам разобраться в сложной структуре химических соединений.
Примеры определения степени окисления

Определение степени окисления в химических соединениях позволяет понять, какие атомы находятся в окисленном или восстановленном состоянии. Рассмотрим несколько примеров определения степени окисления:
- Атом в веществе: когда рассматривается отдельный атом в химическом соединении, его степень окисления определяется по его валентности.
- В пероксидах: степень окисления атома кислорода в пероксидах (например, водородном пероксиде H2O2) равна -1.
- В кислородах: степень окисления атома кислорода в кислородах (например, кислородной кислоте HNO3) равна -2.
- В ионах: степень окисления ионов определяется по их заряду. Например, степень окисления иона калия (K+) равна +1, а иона натрия (Na+) также равна +1.
- Вокруг центрального атома: при определении степени окисления атома, окружающего центральный атом, степень окисления определяется по разделению электронов.
Приведенные примеры демонстрируют основные способы определения степени окисления в химических соединениях. Понимание степени окисления позволяет устанавливать причины химических реакций и предсказывать их характер и возможность. Это важный аспект в области химии и позволяет более глубоко изучать химические процессы.
Способы определения степени окисления в неорганической химии

Существуют различные способы определения степени окисления в неорганической химии. Один из них основан на технике электронного скачка. При этом используется электропотенциал водорода в стандартной водородной шкале (нулевой электродный потенциал), а также известные электродные потенциалы стандартных полуячеек.
Другим способом является использование пероксидные электролизера для определения степени окисления элемента. При этом происходят электрохимические процессы, которые позволяют определить степень окисления элемента при прохождении тока через раствор с соединениями этого элемента.
Также существует способ определения степени окисления с помощью указания валентной формулы соединения. Это основано на известном факте, что сумма степеней окисления всех элементов в химическом соединении должна равняться нулю.
Другие методы включают использование спектрофотометрии, рентгеноструктурного анализа и других инструментальных методов. Они позволяют определить структуру соединения и тем самым установить степень окисления элемента.
Способы определения степени окисления в органической химии

Степень окисления в органических соединениях можно определить различными способами. Ниже приведены некоторые из них:
- Метод очередности замещения. Данный метод основан на анализе реакций замещения, при которых изменяется степень окисления атомов в молекулах органических соединений.
- Метод анализа степени насыщения. Степень насыщения органических соединений связана с количеством двойных и тройных связей в молекулах данных соединений. Путем анализа структуры молекулы можно определить степень окисления атомов.
- Метод анализа окислительно-восстановительных реакций. Окислительно-восстановительные реакции позволяют определить изменение степени окисления атомов в молекулах органических соединений.
- Метод спектроскопии. Спектроскопические методы, такие как ИК-спектроскопия и ЯМР-спектроскопия, позволяют анализировать структуру молекулы и определить степень окисления атомов.
- Метод анализа реакций с участием галогенов. Реакции с участием галогенов позволяют определить изменение степени окисления атомов в молекулах органических соединений.
Каждый из перечисленных способов имеет свои особенности и применим в зависимости от конкретной задачи исследования. Определение степени окисления в органической химии является важной составляющей анализа и позволяет более глубоко изучить свойства органических соединений.
Значение определения степени окисления в химии
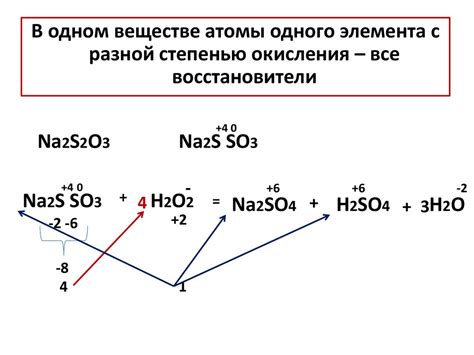
Определение степени окисления играет важную роль в практической химии. Например, при проектировании и разработке электрохимических систем, знание степени окисления позволяет оптимизировать процессы и повысить эффективность работы системы.
Таким образом, определение степени окисления является важным инструментом для изучения и понимания химических реакций, а также имеет практическое применение в различных областях химии.
Применение определения степени окисления

В неорганической химии определение степени окисления используется для расчета баланса реакций и определения окислителей и восстановителей. Зная степень окисления атомов различных элементов в реагентах и продуктах реакции, можно определить, какие атомы окисляются, а какие восстанавливаются. Это позволяет более полно понять, как протекает химическая реакция и какие реакции могут быть сопровождены обменом электронов.
В органической химии определение степени окисления используется для определения функциональных групп в органических соединениях. Функциональные группы - это группы атомов, которые определяют свойства органических соединений. Зная степень окисления углерода в органической молекуле, можно определить, какие функциональные группы присутствуют в данном соединении. Например, степень окисления -2 указывает на присутствие алкенов, а степень окисления 0 говорит о наличии алканов.
Определение степени окисления также полезно при решении задач по определению химической формулы соединений. Зная степень окисления каждого элемента в соединении, можно составить систему уравнений, которая позволит определить количество каждого элемента в молекуле. Это позволяет более точно определить химическую формулу неизвестного соединения.
Применение определения степени окисления в химии позволяет углубить понимание реакций и веществ, а также использовать этот инструмент для решения практических задач и проблем. Знание степени окисления является важным компонентом химического образования и позволяет осуществлять анализ и синтез химических соединений.