Ковалентная связь - это одна из основных форм химической связи, возникающая между атомами при общем использовании их электронов в области образования общей электронной пары. В этом виде связи атомы обмениваются парами электронов, что позволяет им достичь большей устойчивости и образовать молекулы различных соединений. Ковалентные связи являются основой для формирования сложной структуры всех органических и неорганических веществ, а также отвечают за их физические и химические свойства.
Происхождение ковалентной связи может быть объяснено через общую теорию электронного строения атомов. По этой теории, атомы стремятся достичь электронной октаэдрической конфигурации - состояния с заполненной внешней оболочкой из восьми электронов, аналогичное электронной конфигурации благородных газов. Для этого атомы могут обратиться к обмениванию электронами для заполнения пустых мест или совместного использования электронов с другими атомами. Это приводит к образованию ковалентной связи между атомами.
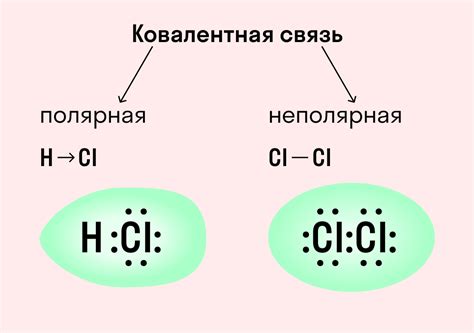
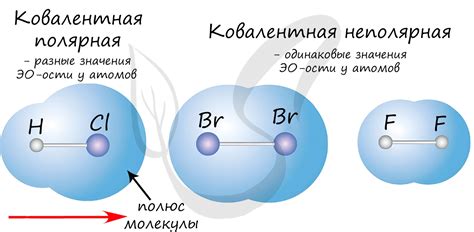
Интересно, что ковалентная связь может быть полярной или неполярной в зависимости от того, насколько сильно электроотрицательность атомов, образующих связь, отличается друг от друга. Если атомы имеют одинаковую электроотрицательность, связь считается неполярной и электроны равномерно распределены между атомами. В противоположность этому, если атомы имеют различную электроотрицательность, связь считается полярной, что означает, что электроны смещаются ближе к атому с более высокой электроотрицательностью, создавая разницу в зарядах и образуя положительный и отрицательный полюса.
Что такое ковалентная связь?

В ковалентной связи электроны двух атомов образуют общую электронную пару, что позволяет им быть связанными вместе. Ковалентная связь приводит к образованию молекул и характеризуется тем, что электроны могут быть распределены неравномерно между атомами.
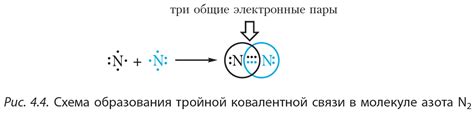
Ковалентные связи могут быть одиночными, двойными или тройными, в зависимости от числа электронных пар, которыми атомы делятся между собой. Одиночная ковалентная связь включает в себя одну электронную пару, двойная - две, а тройная - три.
Также ковалентные связи могут быть полярными или неполярными. Поляризованная ковалентная связь возникает, когда электроны в общей электронной паре проводят больше времени рядом с одним атомом, создавая разность в заряде между атомами. Неполярная ковалентная связь, наоборот, образуется, когда электроны проводят одинаковое количество времени рядом с каждым атомом, создавая равномерное распределение заряда.
Ковалентная связь является одной из самых распространенных форм химических связей и играет ключевую роль в формировании молекул различных веществ.
Ковалентная связь: основные особенности
Основные особенности ковалентной связи:
| 1. Совместное использование электронов | В ковалентной связи атомы делят пару электронов, образуя общую электронную оболочку. Таким образом, каждый атом вносит вклад в образование связи. |
| 2. Образование молекул | Ковалентная связь позволяет атомам объединяться в молекулы. Молекулы могут состоять из одного или нескольких атомов одного или разных элементов. |
| 3. Стойкость связи | Ковалентная связь обладает высокой стойкостью, так как образуется за счет совместного использования электронов атомами. |
| 4. Полярность связи | Ковалентная связь может быть полярной или неполярной. Полярная связь возникает, когда электроотрицательности атомов, образующих связь, различаются. |
| 5. Влияние длины и силы связи | Длина и сила ковалентной связи зависят от типа атомов, их валентностей и других факторов, таких как топология молекулы. |
Ковалентная связь – одна из самых распространенных и важных форм связи между атомами, она лежит в основе органической и неорганической химии, а также имеет большое значение в биологии и физике.
Причины образования ковалентной связи
Ковалентная связь возникает между атомами элементов в результате взаимного обмена электронами. Существует несколько причин, которые приводят к образованию ковалентной связи:
1. Недостаток электронов: Атомы, у которых недостаточно электронов во внешнем электронном слое, стремятся заполнить свой слой, объединяясь с другими атомами путем обмена электронами. Таким образом, образуется ковалентная связь, которая позволяет атомам достичь электронной стабильности.
2. Перекрытие орбиталей: Атомы имеют электронные орбитали, которые могут перекрываться друг с другом. Приближение орбиталей приводит к образованию общих областей перекрытия, в которых электроны могут находиться совместно. Это образует ковалентную связь между атомами.
3. Величина энергии: Ковалентная связь формируется при определенной энергии системы. Атомы стремятся к состоянию минимальной энергии, поэтому между ними образуется ковалентная связь, при которой образуется более стабильная и низкоэнергетическая система.
4. Вид электронного перераспределения: Образование ковалентной связи может быть результатом различных процессов электронного перераспределения. Это может включать обмен, заимствование или удержание электронов атомами для достижения полностью заполненного внешнего электронного слоя.
Таким образом, причины образования ковалентной связи включают недостаток электронов, перекрытие орбиталей, энергию системы и вид электронного перераспределения. Эти факторы играют важную роль в стабилизации атомов и формировании разнообразных соединений в химии.
Происхождение ковалентной связи
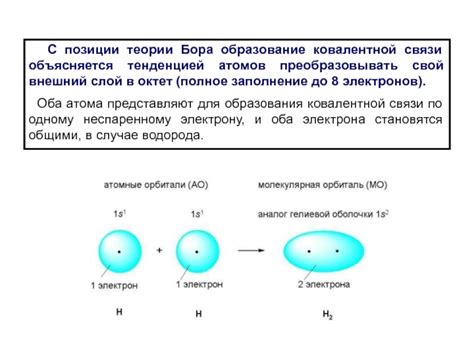
Когда два атома сближаются, их внешние электроны начинают взаимодействовать друг с другом. Каждый атом стремится заполнить свою внешнюю электронную оболочку, имеющую максимальное количество электронов. В результате этого процесса атомы могут обменивать и делиться электронами, чтобы достичь электронной конфигурации инертного газа.
Когда атомы обменивают электроны, они образуют пару электронов, называемую электронной парой. Эти электронные пары становятся общими для обоих атомов и окружают их ядра, создавая ковалентную связь. Значительное энергетическое выигрышное получается при образовании ковалентной связи, что делает ее очень стабильной.
Процесс образования ковалентной связи может быть ионным или симметричным. В ионной связи один атом отдает электроны другому, что приводит к образованию положительного и отрицательного ионов. С другой стороны, в симметричной ковалентной связи атомы делают взаимный вклад, деля электронные пары поровну.
Таким образом, происхождение ковалентной связи может быть объяснено в терминах электронной структуры атомов и их стремления к достижению стабильности. Обмен и совместное использование электронов позволяют атомам образовывать ковалентные связи и обеспечивают сильную и устойчивую химическую связь между ними.
Открытие и развитие теории ковалентной связи
Теория ковалентной связи была предложена в начале XX века и стала одной из основных теорий химической связи. Она основана на представлении о том, что атомы в молекуле соединяются путем обмена или совместного использования своих валентных электронов.
Одним из первых исследователей, который предложил и развил теорию ковалентной связи, был Гилберт Ньютоун Льюис. В 1916 году он сформулировал основные идеи этой теории в своей статье "Связь и стереосвязь веществ". Льюис отметил, что атомы стремятся достичь наиболее стабильного состояния, заполнив оболочку с восемью электронами. Он предложил понятие "октетного" состояния, когда атом образует связь для заполнения своей внешней оболочки.
С развитием квантовой механики в 1920-30 годах, теория ковалентной связи получила математическое обоснование. Ученые Линус Полинг и Роберт Малликен провели теоретическое исследование и разработали концепцию орбиталей, которая объясняла электронную структуру атомов и молекул. Орбитали представляют собой области пространства, где вероятность нахождения электрона наибольшая.
С помощью концепции орбиталей было возможно объяснить формирование связей между атомами в молекулах. Теория ковалентной связи была значительно расширена и углублена в работах многих ученых, включая Льюиса, Полинга, Малликена и других.
С развитием теории ковалентной связи возникли также различные модели, которые объясняли различные аспекты связывания атомов. Например, модель Валенса-Бонда, разработанная Линусом Полингом, описывает молекулы с помощью гибридизации орбиталей атомов. Модель молекулярных орбиталей разработана Робертом Малликеном и дает более детальное представление о распределении электронной плотности в молекуле.
Теория ковалентной связи является одной из основных основ химической связи и находит применение во многих областях науки и техники. Она позволяет предсказывать свойства и реакционную способность молекул, а также создавать новые соединения с определенными свойствами и функциями.
Применение ковалентной связи
Ковалентная связь имеет множество применений в различных областях научных и технических дисциплин.
Органическая химия: Ковалентная связь является основой органической химии, именно она определяет структуру и свойства органических соединений. Большинство органических соединений состоят из углерода, который образует ковалентные связи с другими атомами, такими как водород, кислород, азот и другие элементы.
Материаловедение: Ковалентная связь является фундаментальной для понимания и создания различных материалов. Например, полимеры состоят из молекул, объединенных ковалентными связями, что дает им свойства, такие как прочность и эластичность.
Фармацевтическая промышленность: В фармацевтике ковалентная связь играет важную роль в разработке лекарственных препаратов. Множество лекарств содержит активные компоненты, которые образуют ковалентные связи с молекулярными целями в организме, что позволяет им выполнять свои функции.
Электроника: Ковалентная связь используется в создании полупроводниковых материалов, таких как кремний и германий, которые являются основой для различных электронных устройств, таких как транзисторы и микросхемы.
Катализ: Ковалентная связь может быть использована в катализе различных химических реакций. Например, в катализе метатеза используются комплексы металлов, которые образуют ковалентную связь с реагирующими молекулами, ускоряя химическую реакцию.
Таким образом, ковалентная связь имеет широкий спектр применений и играет важную роль в различных научных и технических областях.
Ковалентная связь в органической химии

Органическая химия изучает соединения, содержащие углерод. Углерод – основной элемент, образующий ковалентные связи с другими атомами, такими как водород, кислород, азот и другие. Именно ковалентные связи между атомами углерода позволяют создавать огромное количество различных органических соединений с разнообразными свойствами и функциями.
Ковалентная связь в органической химии особенно важна для понимания структуры и свойств органических соединений. Межатомные связи могут быть одинарными, двойными или тройными, в зависимости от количества обменных пар электронов. Ковалентные связи также влияют на форму и геометрию молекул, что может определять их реакционную активность и химические свойства.
- Одна из наиболее распространенных ковалентных связей в органической химии – связь C-C. Она играет фундаментальную роль в органической химии и образует основу углеродного скелета молекулы.
- Помимо связи C-C, в органической химии образуются также другие ковалентные связи, такие как связи C-H, C-O, C-N и т.д. Каждая из этих связей имеет свою собственную химическую активность и может влиять на свойства органических соединений.
- Ковалентные связи также могут быть полярными или неполярными. Полярность связи зависит от разности электроотрицательности атомов, связанных между собой. Полярность может влиять на растворимость органических соединений и их взаимодействие с другими веществами.
Изучение ковалентной связи в органической химии позволяет нам понять, как образуются и существуют органические соединения, и как они взаимодействуют друг с другом и с окружающей средой. Это знание важно для разработки новых лекарств, материалов и других органических продуктов, а также для понимания механизмов химических реакций.
Ковалентная связь в неорганической химии

В неорганической химии ковалентная связь играет важную роль в образовании соединений, таких как соли, оксиды, кислоты и основания. В таких соединениях ковалентная связь присутствует не только между атомами одного и того же элемента, но и между атомами различных элементов.
Особенностью ковалентной связи в неорганической химии является то, что атомы обменивают электроны таким образом, чтобы достичь состояния с наименьшей энергией. При этом электроны становятся общими для обоих атомов, что обеспечивает их взаимную прочность и стабильность.
Межатомные расстояния и углы в ковалентных соединениях могут быть различными и зависят от природы атомов, их валентности и структуры молекулы. Описание ковалентных связей и взаимного расположения атомов в молекуле позволяет предсказывать и объяснять многие свойства неорганических соединений.