Ковалентная связь – это тип химической связи, которая возникает между атомами через обмен электронами. Однако, когда атомы не разделяют электроны равномерно и электроотрицательности их различаются, образуется ковалентная полярная связь.
В результате ковалентной полярной связи, один из атомов притягивает электроны сильнее, чем другой. Атом, притягивающий электроны с большей силой, становится немного отрицательным, а атом, отдающий электроны, становится немного положительным. Таким образом, образуется диполь с положительной и отрицательной характеристикой.
Примеры ковалентной полярной связи включают молекулы воды (H2O), аммиак (NH3) и фторид водорода (HF). В молекуле воды, атомы кислорода и водорода разделяют свои электроны неравномерно, что создает полярную связь. Таким образом, атом кислорода в молекуле воды становится негативно заряженным, а атомы водорода – положительными.
Ковалентная полярная связь: основные принципы и примеры
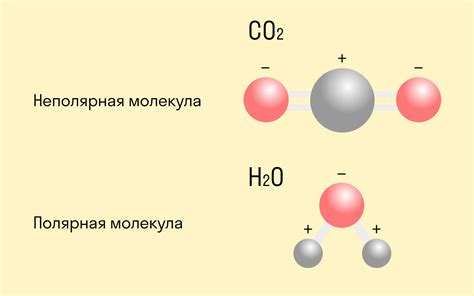
Основным принципом ковалентной полярной связи является симметричное разделение электронного облака между атомами. Атом с большей электроотрицательностью притягивает электроны сильнее и приобретает небольшой отрицательный заряд, а атом с меньшей электроотрицательностью приобретает небольшой положительный заряд.
Примером ковалентной полярной связи является связь между атомами водорода и кислорода в молекуле воды. Атом кислорода, обладающий большей электроотрицательностью, притягивает электроны к себе сильнее, получая небольшой отрицательный заряд. Атомы водорода приобретают небольшой положительный заряд. Таким образом, молекула воды становится полярной за счет разделения зарядов.
Другим примером ковалентной полярной связи является связь между атомами водорода и атомами хлора в молекуле соляной кислоты. Атом хлора обладает более высокой электроотрицательностью, поэтому притягивает электроны к себе сильнее, получая небольшой отрицательный заряд. Атомы водорода в данном случае приобретают небольшой положительный заряд.
| Молекула | Электроотрицательность атомов | Направление заряда |
|---|---|---|
| Вода (H2O) | Кислород (3.5), водород (2.2) | Отрицательный заряд у кислорода, положительные заряды у водорода |
| Соляная кислота (HCl) | Хлор (3.0), водород (2.2) | Отрицательный заряд у хлора, положительные заряды у водорода |
Таким образом, ковалентная полярная связь играет важную роль в химии и объясняет множество ее феноменов, включая полярность молекул и их реакционную способность.
Как работает ковалентная полярная связь
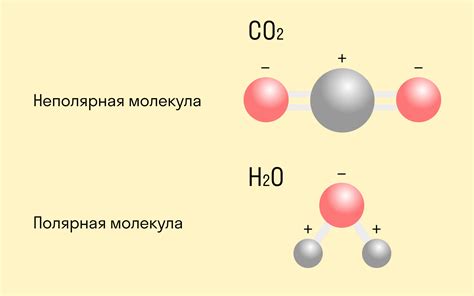
Ковалентная полярная связь возникает, когда два атома разделяют пару электронов, но электроотрицательность атомов различна, поэтому электроны больше притянуты к одному атому, создавая неравномерное распределение электронов в молекуле. Один из атомов будет иметь небольшую δ-зарядку (частично отрицательная), в то время как другой атом будет иметь δ+зарядку (частично положительная).
Эта разность в электроотрицательности создает полярность в ковалентной связи и приводит к образованию диполя, поскольку центры положительного и отрицательного заряда разделяются. Более электроотрицательный атом обычно привлекает большую долю электронной плотности, поэтому он будет иметь отрицательный частичный заряд, в то время как менее электроотрицательный атом будет иметь положительный частичный заряд. Это создает полярность в связи и делает ее полярной.
Ковалентная полярная связь может проявлять себя в различных молекулах и соединениях. Например, водные молекулы (H2O) образуют полярную связь между атомом кислорода и атомами водорода, поскольку кислород более электроотрицателен. Это приводит к формированию частично отрицательной зарядки на атоме кислорода и частично положительной зарядки на атомах водорода.
Ковалентная полярная связь имеет важное значение в химии и обладает рядом важных свойств. Она может создавать различные свойства веществ, такие как важность воды как универсального растворителя, возможность образования водородных связей и т. д. Понимание механизма работы ковалентной полярной связи помогает объяснить различные химические реакции и взаимодействия.
Примеры ковалентной полярной связи в химии
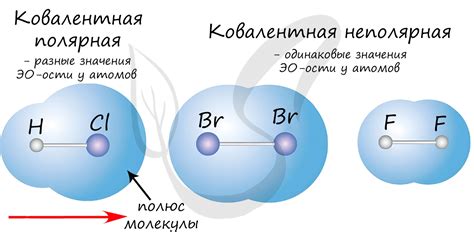
Примерами ковалентной полярной связи могут служить следующие соединения:
- Вода (H2O): Водный молекула состоит из атома кислорода, связанного с двумя атомами водорода. В связи между кислородом и водородом имеет место перераспределение электронов, создавая разность электроотрицательности и обусловливая полярную связь.
- Аммиак (NH3): Молекула аммиака состоит из атома азота и трех атомов водорода. В этом соединении атом азота обладает большей электроотрицательностью, чем атомы водорода, что создает полярную связь между ними.
- Сероводород (H2S): Сероводород состоит из атома серы и двух атомов водорода. Электроотрицательность серы больше, чем у водорода, поэтому имеет место полярная связь.
Все эти соединения обладают полярностью, которая обусловлена разностью в электроотрицательности атомов, связанных в молекуле.