Концентрация реагирующих веществ является одним из ключевых факторов, определяющих скорость химической реакции. Высокая концентрация обеспечивает большое количество частиц, способных взаимодействовать друг с другом, что увеличивает вероятность столкновений и, соответственно, скорость реакции.
Увеличение концентрации может быть достигнуто, например, путем увеличения количества реагирующих веществ или уменьшения объема реакционной смеси. Важно помнить, что при определенной концентрации реакция может достичь предельной скорости, когда все реагенты уже полностью потребованы реакцией и дальнейшее увеличение концентрации не приведет к увеличению скорости.
Кроме концентрации, скорость реакции может быть изменена путем изменения других факторов, таких как температура, наличие катализаторов или поверхность реагирующих веществ. Взаимодействие всех этих факторов может быть сложным и часто зависит от конкретной реакции.
Влияние концентрации на скорость реакции

Одна из причин такого влияния заключается в том, что увеличение концентрации приводит к увеличению числа молекул реагентов в единице объема. Это повышает вероятность столкновения молекул реагентов и, следовательно, вероятность успешного протекания реакции.
Повышение концентрации реагентов также может увеличить концентрацию активных частиц реагентов, то есть молекул, которые обладают энергией, достаточной для протекания реакции. Как только молекула с достаточной энергией столкнется с другой молекулой реагента, реакция начинается.
Однако существует предельное значение концентрации, после которого дальнейшее увеличение концентрации не будет приводить к увеличению скорости реакции. Это связано с тем, что при высокой концентрации реагентов уже все активные частицы участвуют в реакции, а добавление дополнительных молекул не приведет к увеличению числа успешных столкновений и, следовательно, скорости реакции.
Эффект коллизий и концентрация реагентов

Однако, не все коллизии приводят к реакциям. Чтобы коллизия была эффективной, молекулы реагентов должны иметь достаточно энергии для преодоления энергетического барьера реакции. Значительную роль играет при этом концентрация реагентов.
Концентрация реагентов – это количество реагентов, содержащихся в единице объема. Высокая концентрация реагентов повышает вероятность коллизий и, соответственно, скорость реакции. Если концентрация реагентов низкая, количество коллизий будет меньше, и реакция пройдет медленнее.
Кроме того, концентрация реагентов может быть поддержана постоянной за счет непрерывного добавления реагентов или использования катализаторов. Это позволяет увеличить скорость реакции и получить большее количество продукта.
Таким образом, эффект коллизий и концентрация реагентов тесно связаны и играют важную роль в процессе химической реакции. Повышение концентрации реагентов увеличивает вероятность эффективных коллизий, а значит, ускоряет химическую реакцию.
Изменение скорости реакции в зависимости от концентрации

Скорость химической реакции зависит от концентрации веществ, принимающих участие в этой реакции. Чем выше концентрация реагентов, тем быстрее протекает реакция. Чтобы увидеть эту зависимость, необходимо провести опыт и измерить скорость реакции при разных значениях концентрации.
Для исследования зависимости скорости реакции от концентрации используют метод титрования. При этом вещество, изменяющее концентрацию, добавляют к равновесной смеси реагентов. После каждого добавления измеряют время, за которое происходит изменение химической реакции.
Результаты такого опыта можно представить в виде таблицы. Ниже приведена таблица, отражающая зависимость скорости реакции от концентрации веществ.
| Концентрация реагентов | Время реакции |
|---|---|
| 0,1 М | 10 сек |
| 0,2 М | 8 сек |
| 0,3 М | 6 сек |
Как видно из таблицы, с увеличением концентрации реагентов время реакции уменьшается. Это свидетельствует о том, что скорость реакции при большей концентрации выше, чем при меньшей концентрации.
Предельное значение концентрации реагентов
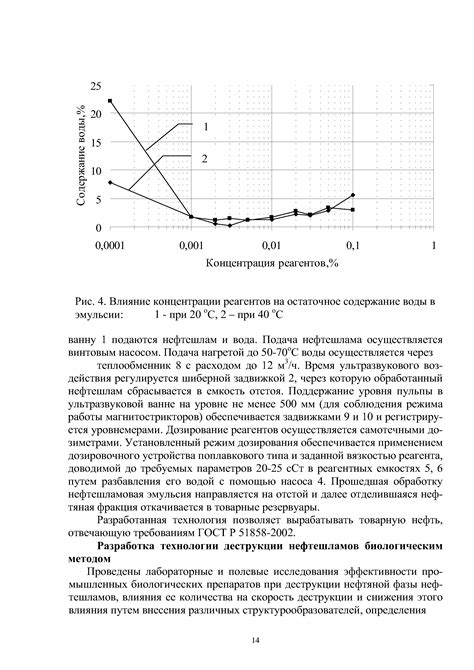
Для определения предельного значения концентрации реагентов необходимо учесть стехиометрическое соотношение между реагентами. Концентрация каждого реагента должна быть не меньше его коэффициента в балансовом уравнении реакции.
Часто предельное значение концентрации обозначается как [A]₀ и [B]₀ для реагентов A и B соответственно. Они указывают на начальную концентрацию реагентов в начальный момент времени, когда реакция только начинает протекать.
Рассмотрим пример реакции между водородом (H₂) и кислородом (O₂) для образования воды (H₂O). Балансовое уравнение для данной реакции выглядит следующим образом:
| Реаганты | Коэффициенты |
|---|---|
| H₂ | 2 |
| O₂ | 1 |
| H₂O | 2 |
Следовательно, предельное значение концентрации H₂ должно быть не меньше 2 раз его коэффициента, а концентрация O₂ - не меньше его коэффициента 1.
Знание предельных значений концентрации реагентов позволяет определить порядок реакции и скорость реакции. Более высокие значения концентрации реагентов могут привести к увеличению скорости реакции, так как большее количество молекул реагентов принимает участие в столкновениях и образовании продуктов.
Скорость реакции при максимальной концентрации

Если концентрация реагентов максимальна, то чаще всего реакция протекает с максимально возможной скоростью. Это связано с тем, что при высокой концентрации реагентов больше коллизий между частицами происходит за счет большего количества этих частиц в единице объема. Большее количество коллизий обуславливает большую вероятность успешного столкновения и образования продуктов реакции.
Однако, при максимальной концентрации реагентов могут происходить и параллельные реакции, которые также влияют на скорость химического процесса. Параллельные реакции могут конкурировать с основной реакцией и снижать ее скорость. Также возможно наличие обратной реакции, когда продукты реакции вновь превращаются в исходные вещества. Это может оказывать дополнительное влияние на скорость реакции при максимальной концентрации.
Следует отметить, что скорость реакции при максимальной концентрации реагентов может быть разной в зависимости от конкретного типа реакции и условий, в которых она проводится. Для каждой реакции существует свой оптимальный диапазон концентраций, при которых достигается максимальная скорость реакции.
Оптимальная концентрация для достижения максимальной скорости реакции

Концентрация реагентов играет важную роль в химических реакциях, влияя на скорость и эффективность процесса. Оптимальная концентрация для достижения максимальной скорости реакции зависит от множества факторов, таких как тип реакции, температура, давление и наличие катализаторов.
В общем случае, увеличение концентрации реагентов приводит к ускорению реакции. Это связано с тем, что при более высокой концентрации реагентов их молекулы сталкиваются чаще, что увеличивает вероятность образования комплекса активации и прохождения реакции.
Однако, существует предельная концентрация, после которой дальнейшее увеличение концентрации не приводит к увеличению скорости реакции. Это связано с тем, что при высоких концентрациях реагентов молекулы сталкиваются настолько часто, что больше времени уходит на рассеивание энергии, а не на химическую реакцию.
Оптимальная концентрация зависит от конкретной реакции и может быть определена экспериментально. Часто она находится в диапазоне, где скорость реакции и эффективность процесса наивысшие.
Оптимальная концентрация реагентов может быть достигнута путем изменения начальных концентраций или добавлением ингредиентов, которые влияют на концентрацию. Также, важно учитывать, что оптимальная концентрация может меняться при изменении других условий реакции, таких как температура или наличие катализаторов.
В итоге, для достижения максимальной скорости реакции необходимо определить оптимальную концентрацию реагентов, учитывая все факторы, которые могут на нее влиять. Это поможет повысить эффективность химического процесса и ускорить его проведение.