Количество молей вещества – это одна из основных характеристик, используемая в химических расчетах и является мерой количества вещества. Оно выражается в единицах молей и позволяет установить соотношение между массой вещества и его химическим составом.
Формула для расчета количества молей вещества в основе основ основ химического равенства:
n = m/M ,
где n - количество молей вещества,
m - масса вещества,
M - молярная масса вещества.
Для лучшего понимания данной формулы и способа ее применения рассмотрим пример: расчет количества молей кислорода в молекуле воды (H2O).
Масса одной молекулы воды равна молярной массе этого вещества и составляет около 18 г/моль. Допустим, у нас есть 36 г воды. Чтобы найти количество молей в данном случае, мы должны разделить массу на молярную массу:
n = 36 г / 18 г/моль = 2 моль.
Таким образом, в 36 г воды содержится 2 моля кислорода.
Формула расчета количества молей вещества

Количество молей вещества может быть рассчитано с помощью следующей формулы:
количество молей = масса вещества / молярная масса
В этой формуле:
- количество молей - количество единиц вещества, которое можно найти в данной массе вещества;
- масса вещества - общая масса данного вещества;
- молярная масса - средняя масса одной молекулы или формулы вещества, выраженная в граммах на моль.
Правильный расчет количества молей вещества является важным шагом в химических расчетах и позволяет определить соотношения между веществами в химической реакции.
Понятие моля и его значение

Значение моля в химии основано на представлении о реальных атомах и молекулах, которые являются основными строительными блоками вещества. Методом экспериментальных исследований было установлено, что один моль любого химического вещества содержит одинаковое число элементарных частиц - приблизительно 6,022 х 10^23, что называется постоянной Авогадро.
Зная массу атома, молекулы или иона вещества, мы можем вычислить их количество, разделив массу на молярную массу, которая определяется как масса одного моля вещества. Таким образом, значение мольной массы выступает важным понятием в химии.
Универсальность понятия моля и его значение заключается в том, что они позволяют устанавливать точные пропорции элементов в химических реакциях и проводить расчеты количества вещества в различных химических процессах. Это особенно важно при определении эффективности и эффективных дозагрузках в различных катализаторных системах и исследовании химической связи и реакций.
Молекулярная масса и ее определение

Молекулярная масса является важным показателем, который позволяет определить количество молекул вещества и провести расчеты при составлении химических уравнений и определении стехиометрических соотношений.
Молекулярную массу вещества можно определить, зная массу каждого атома, входящего в молекулу, и их количество.
Для определения молекулярной массы вещества можно использовать таблицу периодических элементов. В таблице указана атомная масса каждого химического элемента. Молекулярная масса вычисляется как сумма произведений атомных масс атомов каждого элемента на их количество в молекуле.
Пример расчета молекулярной массы. Рассмотрим молекулу воды (H2O). В молекуле воды содержатся два атома водорода и один атом кислорода. Атомная масса водорода равна 1 г/моль, атомная масса кислорода равна 16 г/моль. Следовательно, молекулярная масса воды равна 1 * 2 + 16 = 18 г/моль.
| Элемент | Атомная масса, г/моль |
|---|---|
| Водород (H) | 1 |
| Кислород (O) | 16 |
| Азот (N) | 14 |
| Углерод (C) | 12 |
Таким образом, молекулярная масса воды равна 18 г/моль.
Количество молей и его зависимость от массы вещества

Формула для расчета количества молей выглядит следующим образом:
n = m/M
Где:
- n - количество молей вещества;
- m - масса вещества;
- M - молярная масса вещества.
Например, если нам известно, что масса вещества составляет 10 г, а его молярная масса равна 20 г/моль, то количество молей можно рассчитать следующим образом:
n = 10 г / 20 г/моль = 0.5 моль
Таким образом, в данном случае количество молей вещества равно 0.5 моль.
Зная количество молей вещества, можно провести различные расчеты, например, определить количество атомов или молекул в данном количестве вещества.
Молярный объем и его роль в расчете количества молей
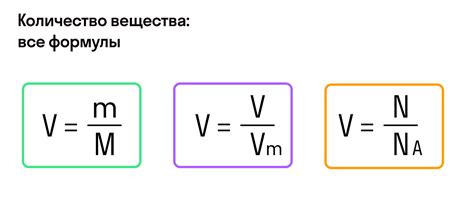
Молярный объем играет важную роль в расчетах количества молей вещества, так как позволяет перейти от массы вещества к его объему и наоборот. Формула для расчета количества молей, используя молярный объем, выглядит следующим образом:
n = V / Vm
где n - количество молей вещества, V - объем вещества, а Vm - молярный объем.
Например, если нам нужно рассчитать количество молей азота в 1 литре данного газа при нормальных условиях (температуре 0°C и давлении 1 атм), мы можем использовать известное значение молярного объема для азота, которое составляет 22,4 л/моль. Подставляя значения в формулу, получим:
n = 1 л / 22,4 л/моль ≈ 0,045 молей
Таким образом, в 1 литре азота при нормальных условиях содержится приблизительно 0,045 молей вещества.
Молярный объем также используется для расчета объема вещества по известному количеству молей. Для этого необходимо переставить формулу и выразить объем:
V = n × Vm
Например, если у нас имеется 2 моль азота, то для расчета объема данного вещества мы можем использовать молярный объем азота (22,4 л/моль). Подставляя значения в формулу, получим:
V = 2 моль × 22,4 л/моль = 44,8 л
Таким образом, 2 моля азота занимают объем 44,8 литра.
Примеры расчета количества молей вещества по массе

Приведем несколько примеров расчета количества молей вещества по массе.
- Пример 1:
- Масса вещества: 40 г
- Молярная масса вещества: 20 г/моль
Для решения этой задачи необходимо поделить массу вещества на молярную массу:
Количество молей вещества = масса вещества / молярная масса вещества = 40 г / 20 г/моль = 2 моль
- Масса вещества: 75 г
- Молярная масса вещества: 25 г/моль
Количество молей вещества = масса вещества / молярная масса вещества = 75 г / 25 г/моль = 3 моль
- Масса вещества: 56 г
- Молярная масса вещества: 28 г/моль
Количество молей вещества = масса вещества / молярная масса вещества = 56 г / 28 г/моль = 2 моль
Все приведенные примеры демонстрируют простой способ расчета количества молей вещества по массе. Эта формула может быть использована в различных химических исследованиях и расчетах, где необходимо учитывать количество частиц вещества.
Примеры расчета количества молей вещества по объему

Количество молей вещества можно рассчитать, зная его объем и молярную массу. Расчет проводится с использованием формулы:
Количество молей = объем / молярная масса.
Ниже приведены несколько примеров расчета количества молей вещества по заданному объему:
Пример 1:
Дано: объем вещества - 250 мл, молярная масса - 58 г/моль.
Расчет: количество молей = 250 мл / 58 г/моль = 4,31 моль.
Ответ: количество молей вещества равно 4,31 моль.
Пример 2:
Дано: объем вещества - 500 мл, молярная масса - 32 г/моль.
Расчет: количество молей = 500 мл / 32 г/моль = 15,63 моль.
Ответ: количество молей вещества равно 15,63 моль.
Пример 3:
Дано: объем вещества - 1000 мл, молярная масса - 72 г/моль.
Расчет: количество молей = 1000 мл / 72 г/моль = 13,89 моль.
Ответ: количество молей вещества равно 13,89 моль.
Важно помнить, что для точности расчета необходимо использовать точные значения объема и молярной массы вещества. Также следует обратить внимание на единицы измерения объема, чтобы они соответствовали единицам молярной массы.
Значение расчета количества молей в химических реакциях
Одной из основных концепций химии является закон сохранения массы. В соответствии с этим законом, масса реагентов, участвующих в химической реакции, равна массе образовавшихся продуктов. Однако масса может быть неудобной для использования при проведении расчетов, поэтому в химии используется понятие моля.
Моль (в обозначении моль) является единицей измерения количества вещества. Одна моль вещества содержит число частиц, равное числу Авогадро (константа Авогадро). Это число составляет примерно 6,022 × 10^23 частиц на одну моль вещества.
Расчет количества молей вещества основан на использовании молярной массы. Молярная масса - это масса одной моли вещества, выраженная в граммах/моль. Молярная масса каждого элемента или соединения рассчитывается путем сложения атомных масс всех атомов, образующих это вещество, с учетом их количества. Например, молярная масса воды (H2O) составляет примерно 18,015 г/моль.
В химических реакциях, балансировка уравнений позволяет определить отношение между числом молекул каждого реагента и числом молекул продуктов. Это отношение может быть использовано для расчета количества молей вещества, необходимого для проведения реакции в заданных условиях.
Например, рассмотрим следующую реакцию:
- С6H12O6 + 6O2 → 6CO2 + 6H2O
Это уравнение описывает реакцию окисления глюкозы (C6H12O6) при участии кислорода (O2), которая приводит к образованию углекислого газа (CO2) и воды (H2O).
Используя балансировку данного уравнения, мы можем определить, что для полного окисления одной моли глюкозы необходимо 6 молей кислорода. Таким образом, зная количество молей глюкозы, можно посчитать количество кислорода, необходимого для реакции.
Расчет количества молей вещества позволяет химикам оптимизировать процессы синтеза, а также проводить анализ химических реакций. Это важный инструмент для понимания и изучения взаимодействий химических веществ и применяется в таких областях как органическая химия, физическая химия и биохимия.