Химические связи - это уникальные взаимодействия между атомами, которые держат все вещества вокруг нас. Важно понимать и определять типы химических связей, чтобы больше узнать о мире химии. Если вы учитесь в 8 классе и только начинаете изучать химические связи, эта статья предлагает вам основные сведения и советы по определению типов химических связей.
Одним из основных способов определения типа химической связи является анализ электроотрицательности элементов, которые образуют связь. Электроотрицательность - это способность атомов притягивать электроны к себе. Чем выше разница в электроотрицательности между атомами, тем более полярной будет химическая связь. Если разница электроотрицательности между атомами составляет более 1,7, то это обычно свидетельствует о наличии ионной связи. Если разница электроотрицательности между атомами составляет менее 1,7, но больше 0,4, то это неполярная ковалентная связь. Если разница электроотрицательности меньше 0,4, то это полярная ковалентная связь.
Еще одним способом определения типа химической связи является анализ атомарных радиусов элементов. Радиус атома - это расстояние от ядра атома до его внешней электронной оболочки. Если атомарные радиусы элементов различаются настолько, что один атом занимает центральное положение, а другой атом перемещается к его околоцентральному положению, то это свидетельствует о наличии ионной связи. Если атомарные радиусы элементов близки друг к другу и атомы разделяют внешние электроны, то это свидетельствует о наличии ковалентной связи.
Как узнать тип химической связи

Определение типа химической связи вещества играет важную роль в изучении химии. Существует несколько методов, позволяющих определить тип химической связи, которые можно использовать для решения данной задачи.
Первый метод основан на анализе электроотрицательности элементов, входящих в химическую связь. Если электроотрицательность элементов различна, то связь будет ионной. Если электроотрицательность элементов примерно одинакова, то связь будет ковалентной или металлической.
Второй метод основан на анализе валентных электронов. Если элемент имеет дополнительные валентные электроны, то связь будет ковалентной. Если элемент имеет недостаток валентных электронов, то связь будет ионной.
Третий метод основан на анализе физических свойств вещества, таких как температура плавления, электропроводность и т. д. Например, если вещество имеет низкую температуру плавления и высокую электропроводность, то связь будет металлической.
Кроме того, можно использовать специальные химические реакции, которые позволяют определить тип химической связи. Например, растворение вещества вводит элементы в химическую реакцию с другим веществом, что позволяет определить тип связи.
Итак, существует несколько методов, которые позволяют определить тип химической связи. Комбинируя эти методы и проводя соответствующие исследования, можно точно определить тип связи в веществе.
Концепция химической связи

Простейшим примером химической связи является ионная связь. В этом типе связи происходит передача электронов от одного атома к другому, что приводит к образованию положительно и отрицательно заряженных ионов. Эти ионы притягиваются друг к другу и образуют ионную решетку.
Ковалентная связь возникает, когда электроны делятся между атомами. В этом случае образуется пара электронов, называемая связью. Ковалентная связь может быть полярной или неполярной, в зависимости от разности электроотрицательности атомов.
Металлическая связь возникает между металлическими элементами. Она характеризуется перемещением электронов между атомами, что приводит к образованию общей электронной оболочки. Металлическая связь является причиной высокой проводимости тепла и электричества у металлов.
Химическая связь играет важную роль во всех аспектах химии. Она определяет свойства и характеристики всех веществ и является фундаментальным понятием для изучения различных реакций и процессов.
Ковалентная связь
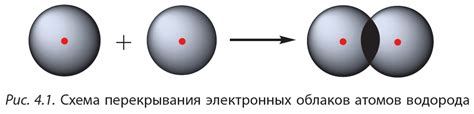
Существуют два вида ковалентной связи: неполярная и полярная. Неполярная ковалентная связь образуется, когда электроны между атомами равномерно распределены. Полярная ковалентная связь возникает, когда электроны более сильно притягиваются одним из атомов.
Ковалентная связь обычно образуется между неметаллами, такими как кислород, азот и хлор. Молекулы с ковалентной связью имеют общие электроны, что делает их более стабильными. Примерами молекул с ковалентной связью являются вода (H2O) и аммиак (NH3).
Определение типа химической связи, включая ковалентную связь, может осуществляться путем анализа разности электроотрицательности атомов, а также их способности принимать или отдавать электроны. Изучение этих характеристик позволяет определить, является ли связь ионной, ковалентной или металлической.
Ионная связь

Ионная связь обладает следующими характеристиками:
- Образуются между металлами и неметаллами.
- Ионы металла отдают электроны, становясь положительно заряженными, а ионы неметалла принимают электроны, становясь отрицательно заряженными.
- Ионы притягиваются друг к другу электростатической силой, образуя кристаллическую решетку.
- Ионная связь обладает высокой прочностью и твердостью.
Примерами веществ, образующих ионную связь, являются хлорид натрия (NaCl), хлорид калия (KCl), оксид магния (MgO) и другие.
Ионная связь играет важную роль в жизни всех организмов, так как обеспечивает передачу сигналов между клетками и регулирует множество биохимических процессов.
Металлическая связь

Электроны в металле могут свободно перемещаться внутри этой общей оболочки, создавая своеобразные "межатомные мосты". Именно благодаря этому свойству металлы обладают высокой электропроводностью и теплопроводностью.
Металлическая связь также отвечает за другие характерные свойства металлов, такие как пластичность, твердость и высокая точка плавления. Под воздействием силы, металл может деформироваться без разрыва связей между атомами, и электроны продолжают свободно перемещаться внутри электронного облака.
В металлической связи энергия образования связи обычно намного меньше, чем в ковалентной или ионной связи. Это позволяет металлам образовывать кристаллическую решетку, где атомы металла выстраиваются в упорядоченные структуры.
Еще одной отличительной особенностью металлической связи является возможность образования сплавов. Сплавы - это соединения из различных металлов, где атомы одного металла находятся в общей электронной оболочке с атомами другого металла. Именно благодаря металлической связи возможно создание сплавов с уникальными свойствами, такими как прочность и коррозионная стойкость.
Таким образом, металлическая связь играет важную роль в определении свойств металлов и позволяет им обладать рядом характеристик, которые делают их важными материалами в различных областях науки и техники.