Атомы состоят из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, в то время как электроны обращаются вокруг ядра. Особенно важным является определение количества электронов на внешнем энергетическом уровне атома. Именно эти электроны влияют на то, как атом взаимодействует с другими атомами и молекулами.
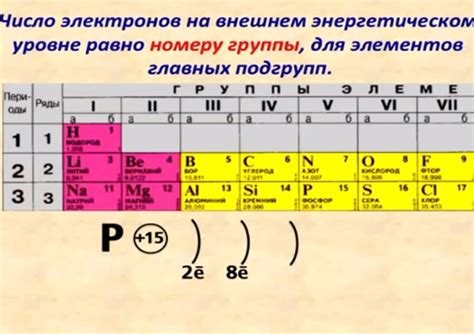
Существуют различные способы определения электронов на внешнем уровне. Один из них - использование периодической таблицы элементов. Каждый элемент имеет указанное количество электронов на своем внешнем энергетическом уровне. Например, кислород (О) находится в шестой группе и имеет 6 электронов на своем внешнем уровне.
Другой способ определить количество электронов на внешнем уровне - использование правила октета. Согласно этому правилу, атомы стремятся иметь 8 электронов на своем внешнем энергетическом уровне, чтобы достичь стабильной электронной конфигурации, подобной инертным газам, таким как неон. Если атом имеет меньше 8 электронов на внешнем уровне, он становится склонным к химическому взаимодействию с другими атомами, чтобы заполнить этот брешь.
Таким образом, определение количества электронов на внешнем уровне является важным фактором при изучении химических свойств атомов. Такие способы, как использование периодической таблицы элементов и правила октета, позволяют установить количество электронов на внешнем уровне и понять, как атом взаимодействует с другими атомами и молекулами.
Ион-логическая модель анализа электронной структуры
Для анализа электронной структуры в ион-логической модели используются некоторые правила и методы. Одно из таких правил - правило закрытой электронной оболочки, которое утверждает, что атом стремится иметь полностью заполненные оболочки электронов.
Другим важным правилом является правило восеми (или октетного правила), которое установлено на основе стабильности атомов и утверждает, что атом стремится иметь 8 электронов на внешнем уровне, как у инертных газов.
Анализ электронной структуры в ион-логической модели осуществляется путем определения заряда ядра и количества электронов на внешнем уровне. Ион с положительным зарядом означает, что число электронов на внешнем уровне меньше 8, в то время как ион с отрицательным зарядом означает, что число электронов на внешнем уровне больше 8.
- Изучение ион-логической модели позволяет более глубоко понять и объяснить особенности химических свойств элементов и их способность к образованию химических связей.
- Ион-логическая модель является основой для построения периодической системы элементов и помогает классифицировать элементы по их электронной структуре.
- Использование ион-логической модели в химии позволяет предсказать реакционную способность элементов и их способность образовывать ионы с определенным зарядом.
Итак, ион-логическая модель анализа электронной структуры является эффективным инструментом для изучения электронного строения атомов и их химических свойств. Она позволяет определить количество электронов на внешнем уровне и заряд иона, что важно для понимания реакций и свойств химических элементов.
Определение электронов по заряду ионов
Ионы - атомы или группа атомов, которые приобрели положительный или отрицательный заряд путем потери или приобретения электронов соответственно. Заряд иона определяется числом протонов в ядре атома и отличается от числа электронов.
Для определения количества электронов на внешнем уровне иона необходимо учесть его заряд. Если заряд иона положителен, то количество электронов на внешнем уровне равно разности между зарядом иона и количеством протонов в ядре атома. Например, ион натрия Na+ имеет заряд +1, а количество протонов в ядре атома Na равно 11. Таким образом, количество электронов на внешнем уровне иона натрия будет равно 10.
Если заряд иона отрицательный, то количество электронов на внешнем уровне равно сумме между зарядом иона и количеством протонов в ядре атома. Например, ион хлора Cl- имеет заряд -1, а количество протонов в ядре атома Cl равно 17. Таким образом, количество электронов на внешнем уровне иона хлора будет равно 18.
| Ион | Заряд | Количество электронов на внешнем уровне |
|---|---|---|
| Na+ | +1 | 10 |
| Cl- | -1 | 18 |
| Ca2+ | +2 | 18 |
Выше представлена таблица с примерами определения количества электронов на внешнем уровне ионов различных элементов.
Заряд ионов может быть полезным инструментом для определения количества электронов на внешнем уровне атомов и ионов. Эта информация важна для понимания химической активности элементов и их способности образовывать химические связи.
Спектроскопические методы определения электронов
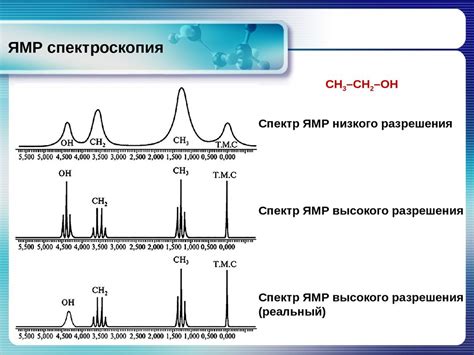
Одним из таких методов является оптическая спектроскопия. Она основывается на анализе поглощения и испускания видимого света атомами вещества. При поглощении света на определенных длинах волн происходят переходы электронов на более высокие уровни энергии, а при испускании света электроны возвращаются на исходные уровни. По форме и интенсивности спектральных линий можно определить количество электронов на внешнем уровне.
Другим спектроскопическим методом является рентгеновская спектроскопия. Она использует рентгеновское излучение для изучения взаимодействия электронов с атомами. Рентгеновские лучи, проходя через вещество, вызывают рассеяние и поглощение, которые зависят от количества электронов на внешнем уровне. Анализ рентгеновских спектров позволяет определить их количество в атомах вещества.
Спектроскопические методы определения электронов на внешнем уровне широко применяются в физике, химии и материаловедении для изучения свойств атомов и молекул. Они позволяют получить ценную информацию о строении и состоянии вещества, что помогает разрабатывать новые материалы и технологии.
Анализ электронной структуры через спектральные линии

Спектральные линии представляют собой уровни энергии, на которых находятся электроны атомов или молекул. Каждая линия соответствует переходу электрона с одного энергетического уровня на другой.
Для проведения анализа электронной структуры через спектральные линии, необходимо определить положение и характер каждой линии. Это может быть сделано с помощью спектрального анализатора, который разделяет излучение на различные длины волн и позволяет изучить спектральные линии.
Анализ спектральных линий позволяет получить информацию о составе атома или молекулы и их электронной структуре. Каждая линия соответствует определенному энергетическому уровню, на котором находятся электроны, а их положение и форма указывают на конкретные свойства этих уровней.
Например, ширина и интенсивность спектральной линии могут быть связаны с вероятностью переходов между энергетическими уровнями и временем жизни электрона на данном уровне. Также, спектральные линии могут быть использованы для определения энергетических уровней и конфигураций электронов в атоме или молекуле.
Анализ электронной структуры через спектральные линии дает возможность получить информацию о взаимодействии электронов в атомах и молекулах, и их энергетических уровнях. Этот метод широко применяется в химических и физических исследованиях, и является важным инструментом для понимания свойств веществ и исследования их структуры.
| Линия | Энергетический уровень | Свойства |
|---|---|---|
| Линия 1 | Уровень 1 | Свойства уровня 1 |
| Линия 2 | Уровень 2 | Свойства уровня 2 |
| Линия 3 | Уровень 3 | Свойства уровня 3 |
Химические методы определения электронов

Один из таких методов - метод локализации электронов, который использует свойства химических соединений. Некоторые соединения могут быть подвержены протеканию реакций и изменению количества электронов на внешнем уровне. Анализ изменений в химических свойствах и изменении количества электронов может позволить определить состав внешней оболочки.
Другой метод - метод анализа ионизации атомов. Ионизация атома происходит при попадании энергии на атом, например, во время химических реакций или при использовании электромагнитного излучения. Метод анализа ионизации позволяет определить количество электронов, которые могут быть сняты с атома.
Также существуют специальные методы определения электронов на внешнем уровне, такие как методэлектронного парамагнитного резонанса (EPR) и метод пространственного распределения электронов (EDS). Эти методы основаны на измерении спинового момента электронов и их энергетического распределения вокруг атома.
Химические методы определения электронов являются важными инструментами в научных исследованиях и применяются в различных областях химии, физики и материаловедения.
Использование реакций образования комплексов

Реакции образования комплексов особенно полезны для химического анализа, так как они позволяют определить наличие и количество определенных ионов или атомов в пробе. Для этого необходимо применить соответствующие методы, например, комплексометрический титрование или спектрофотометрию.
В процессе реакции образования комплексов электроны на внешнем уровне атома или иона могут быть переданы на лиганды, что приводит к образованию стабильных комплексных соединений. При этом образование комплекса может сопровождаться изменением окраски раствора, появлением осадка или изменением pH раствора.
Комплексные соединения имеют множество различных свойств и могут использоваться в различных отраслях науки и техники, например, в катализе, медицине, аналитической химии и фотохимии. Определение электронов на внешнем уровне с помощью реакций образования комплексов является важным инструментом в изучении электронных структур и химических свойств веществ.
Методы теоретического моделирования электронных уровней

Один из подходов к моделированию электронных уровней - это использование теории функционала плотности (DFT). DFT основана на представлении системы электронов в терминах плотности электронов, что позволяет рассчитать энергию системы и электронные свойства. Методы DFT очень популярны в современной физике и химии и широко применяются для изучения различных материалов и систем.
Другим методом теоретического моделирования является метод молекулярных орбиталей (МО). В этом подходе атомные и молекулярные системы представляются в виде линейной комбинации молекулярных орбиталей, которые распространяются по всей системе. Этот метод позволяет рассчитывать энергетические уровни электронов и позволяет изучать более сложные системы, такие как молекулы и молекулярные комплексы.
Квантовая химия также использует методы работы с базисными функциями, такими как базис Льюисовских исходных атомов (LCAO) и методы основанные на разложении по базисным функциям в виде некоторых стандартных функций, таких как функции Гаусса (Гауссовы орбитали). Эти методы позволяют моделировать электронные уровни и электронные свойства атомов и молекул.
Также, для моделирования электронных уровней могут быть применены и другие методы, такие как методы квантовой механики, методы классической механики и методы численного анализа. Каждый из этих методов имеет свои преимущества и ограничения, и выбор метода зависит от конкретных условий и требований исследования.
Теоретическое моделирование электронных уровней играет важную роль в различных областях науки, от физики и химии до материаловедения и биологии. Эти методы позволяют получить важные сведения о свойствах веществ и провести расчеты, которые помогут в дальнейшем улучшении и разработке новых материалов и технологий.